添加日期:2018年8月24日 阅读:2315
医疗器械**标识(Unique Device Identification,简称UDI),是医疗器械产品的身份证。继美国、欧盟落地,日本、澳大利亚、阿根廷、韩国等国家展开工作后,我国也赶上了日程。
2018年8月22日,国家市场监督管理总局发布了《医疗器械**标识系统规则(征求意见稿)》(以下简称《征求意见稿》),阐述了医疗器械**标识系统的总则和要求,旨在提高医疗器械的可追溯性,征求意见仅一个月的时间(2018年8月22日到2018年9月21日)。医疗器械**标识系统即将正式上线!

实际上这次《征求意见》并不是空穴来风,在今年2月28日,原国家食品药品监督管理总局曾发布《医疗器械**标识系统规则(征求意见稿)》及其编制说明,并同步开展了WTO/TBT通报,共收到意见267条,其中针对条款意见96条,主要意见集中在特定类别医疗器械产品的合规、豁免原则、数据上传时限要求、创建新的**标识相关要求和发码机构确定等有关问题。此次《征求意见》在原来的基础上详细了【**标识系统定义】,并且增加了【建设意见】和【发码机构要求】两部分内容。
医械汇将医疗器械**标识(UDI)系统整理如下:
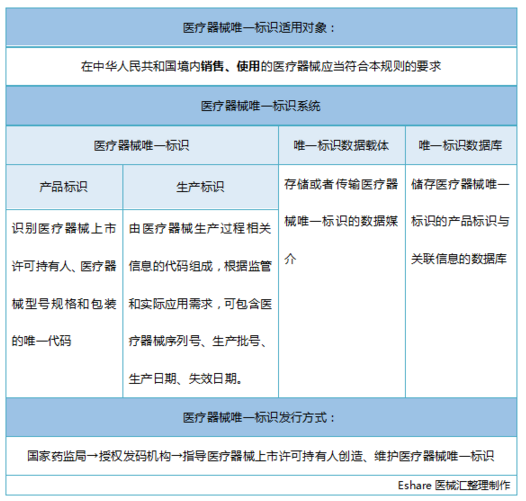
医疗器械**标识是国际医疗器械监管领域关注的热点,是全球医疗器械监管手段创新和效能提升的发展方向。医械汇也整理了已落地的美国与欧盟的UDI相关内容。
美国
美国的医疗器械**标识系统由FDA建立,旨在分配和使用环节充分识别医疗器械。
与我国医疗器械上市许可持有人相对的是美国的医疗器械标签商。标签商是在医疗器械上贴标签或进行标签修改的人,旨在将医疗器械引入州际贸易中,而无需后续更换或修改标签。标签商必须向FDA的全球**器械标识数据库(GUDID)提交每个设备的特定信息。
GUDID由FDA管理,包含所有具有**标识的医疗器械。标有UDI的每个医疗器械的标签商必须将有关该设备的信息提交给GUDID,除非有豁免或替代方法。
目前,FDA授权了三大发码机构分别是:GS1、HIBCC和ICCBBA。
欧盟
Medical Device Directives Revision (2012) Article 24 规定了,除定制或用于实验的医疗器械都需要使用UDI系统。
2012年2月,Eucomed发布了《基于风险管理的不同包装级别医疗器械UDI标识要求》,该文件基于欧盟医疗器械分类III、IIb、IIa和I,对应的美国分类是3、2和1类,提出了不同包装等级下UDI的标识要求。
2017年5月,欧盟发布医疗器械法规,借鉴IMDRF指南和美国FDA法规,明确了欧盟实施医疗器械**标识的要求。
通过建立UDI系统,运用信息化的手段,医院之间、地区之间、省份之间的障碍将全被打通,医疗器械全领域被纳入可追溯的监管之中。无论是主管部门的管理,生产企业的生产,还是经销商的流通,以及医院的使用都能及时在数据库中得到可追溯性的了解。在未来,医械将被置于大众的眼皮子底下,医械行业只会越来越合规。
文章来源:新浪医药网
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号